aktualizováno: 17.09.2010 08:31:17
Suchozemské želvy

| mail | zelvy.kh@seznam.cz |
| mob | |
| mob | 606-945-312 |
..........,,,,,,,,,,,,,,,,,,,,,///////////////////// ..Novinky na webu..
/////////////////////////////////
|
Ještě před samotným úvodem bych rád vyjádřil své poděkování autorce článku a čtenáře upozornil, že mají mimořádnou příležitost zorientovat se v základní problematice "želví parazitologie" v podání autora, jehož teoretické vědomosti i praktické zkušenosti jsou mimořádné. KHor
Web autorky Parazitologie suchozemských želv (část 1)
Úvodem Chovatelů želv v poslední době přibývá a spolu s rostoucí poptávkou po stále nových druzích se rozšiřuje i druhové spektrum želv dovážených přímo z odchytu, nebo z tzv. „farem“. Spolu s tím narůstá i míra našeho poznání na poli želví parazitologie. Zdálo by se tedy, že je vše na dobré cestě překonat některé fámy, které se o želvích parazitech, jejich škodlivosti, prospěšnosti nebo přenosu na člověka nebo jiná domácí zvířata tradují. Bohužel, díky některým veřejně dostupným informačním kanálům (především jde o internet) se to stále jaksi nedaří. Pokusme se to teď změnit detailnějším pohledem na želví parazity, jejich druhy, životní strategie a vývojové cykly. Parazit nebo komenzál?
Jak vypadá a „funguje“ taková „průměrná“ suchozemská želva asi většina návštěvníků těchto stránek ví (pokud ne, má jedinečnou možnost to zjistit detailním pročtením zdejších informací). Jak vypadá, a co vlastně „je“ takový parazit už je otázka o něco složitější. Obecně paraziti využívají jiné organismy na úkor zdraví nebo kondice svých hostitelů. Definice se zdá poměrně jasná, v praxi však existuje mnoho přechodných forem tohoto vztahu. Pokud parazit hostitelskému organismu nijak neškodí, obvykle se nazývá komenzál, pokud hostiteli dokonce pomáhá s některými životními funkcemi (často trávení), můžeme ho nazvat symbiontem (vzpomeňme třeba na bachorové nálevníky přežvýkavců). Hranice mezi neškodným komenzálem a škodlivým parazitem je přitom velice tenká. Může za to především evolučně daná křehká rovnováha, ustavená mezi hostitelským a parazitickým organismem dlouhotrvajícím společným vývojem. Díky nečekaným vnějším vlivům (stres, nevhodná výživa, léčba antibiotiky, chov v omezeném prostoru, zvýšená koncentrace zvířat na jednom místě, přidání nového zvířete do skupiny bez předchozí karantény), se tato rovnováha snadno zhroutí ve prospěch jedné či druhé strany. Narušení přirozené rovnováhy pak může končit jak postupnou samovolnou eliminací parazita, tak zdravotními potížemi hostitele. Suchozemské želvy a jejich paraziti
Suchozemské želvy jsou velice unikátní skupinou živočichů dokonale přizpůsobenou specifickým životním podmínkám. Stejně dokonale jsou přizpůsobeni i paraziti, kteří želvy provázejí po mnoho let společného vývoje. Členovci Klíšťata
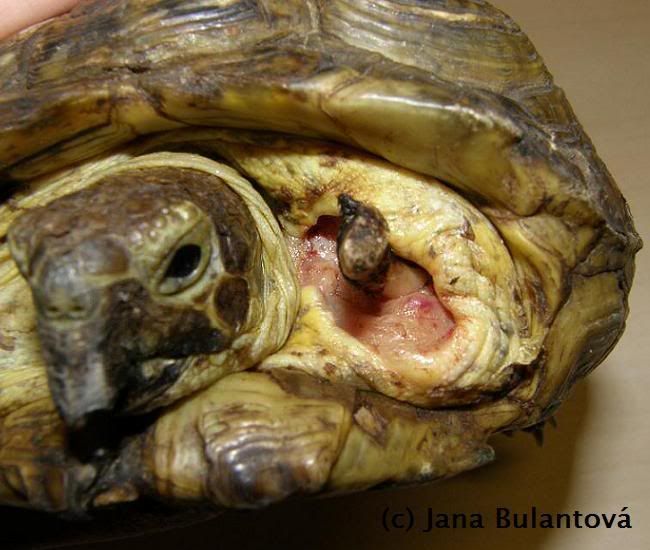
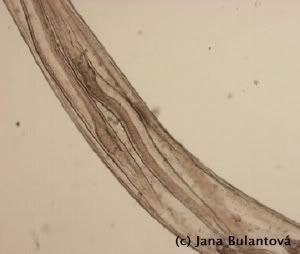
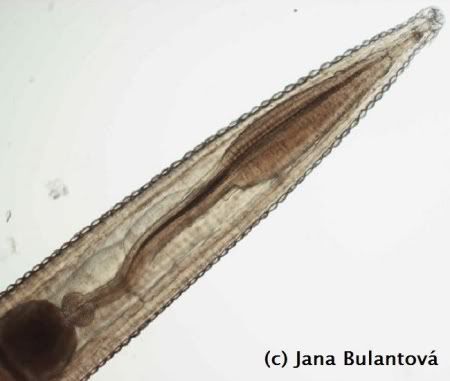
Z ektoparazitů se u želv setkáme nejčastěji s klíšťaty. Obvykle jde o hostitelsky specifické druhy (Amblyomma spp., Hyalomma aegyptium), které jsou k nám dovezeny přímo na importovaných želvách, ojediněle se můžeme setkat i s výjimečným nálezem přisáté nymfy nebo larvy našeho klíštěte obecného (Ixodes ricinus). Klíšťata nacházíme přichycená nejčastěji v oblastech jemnější kůže, tedy v tříslech, kolem ocasu, na krku, na hlavě kolem očí nebo uší, ojediněle i přímo na krunýři mezi rohovinovými štítky (obr.1).
Pro malá mláďata může masivní napadení velkými samicemi (obr. 2) znamenat významnou ztrátu krve), klíšťata jsou však nebezpečná především schopností přenášet onemocnění virového, bakteriálního nebo i parazitárního původu (viz dále). Po mechanickém odstranění sajícího klíštěte se doporučuje ránu pečlivě vydezinfikovat. Můžeme tak předejít problémům se sekundární infekcí v místě sání nebo následnému vzniku abscesů.
Myiáze (napadení larvami bzučivek a jiných dvoukřídlých) Pokud mají želvy chované ve venkovním výběhu velkoplošná otevřená zranění (hluboké odřeniny, úrazy, pokousání), mohou jim do nich mouchy (především pak různé druhy bzučivek) během krátké doby naklást vajíčka. Z nich se velice rychle líhnou larvy požírající odumřelou, ale hlavně i zdravou tkáň. Tím zranění prohlubují a znemožňují jeho hojení (v tomto případě nejde o „léčivé“ muší larvy, které selektivně vyžírají pouze mrtvou tkáň). Pokud larvy proniknou do tělní dutiny, může být následná sepse příčinou úhynu. Prevencí proti myiázám je pravidelná kontrola stavu chovaných zvířat a včasné ošetření vzniklých zranění. V případě již probíhajícího napadení je potřeba všechny larvy mechanicky odstranit, vzniklou ránu vydezinfikovat a pokud možno znemožnit volný přístup hmyzu ke zraněnému místu (obr. 3).
Jazyčnatky (Pentastomida) S jazyčnatkami se u želv setkáme jen velice zřídka. Naprostou většinu navíc najdeme pouze u želv vodních. Jedná se o plicní parazity, kteří patří navzdory svému „červovitému“ vzezření mezi členovce. Jsou úzce hostitelsky specifičtí a pro přenos potřebuje většina z nich mezihostitele (nejčastěji bezobratlého živočicha). Nebezpečí jejich zavlečení do chovu je mizivé, riziko nákazy je vyšší u importovaných jedinců. Prvoci (Protozoa) Bičíkovci
V trávicím traktu naprosté většiny želv (včetně těch odchovaných) najdeme hned několik druhů prvoků (skupina Trichomonadida), kteří u želv fungují spíš jako komenzálové a želvě nijak neškodí. V případě oslabení organismu však mohou výraznou měrou přispět ke zvýšení patologie probíhajícího onemocnění. Stejné prvoky však najdeme i u klinicky naprosto zdravých želv a problémy, které tyto organismy způsobují, jsou obvykle jen sekundární infekcí způsobenou rozvojem jiného problému. Známé jsou případy náhlého nárůstu počtu bičíkovců v trávicím traktu u želv rodu Testudo po častém nevhodném krmení sladkým ovocem. Cukry obsažené v ovoci uvnitř střeva kvasí a vytváří tak nezdravé pH, napomáhající nepřiměřenému nárůstu potenciálně patogenních bakterií a s tím i bičíkovců. Nerovnováha střevní mikroflóry se pak projevuje průjmovým onemocněním spojeným s nebezpečím rychlé dehydratace zvířete. Tento nepříznivý stav trávení se dá v brzké době výrazně zlepšit pouhou úpravou jídelníčku. Významným zástupcem bičíkovců u suchozemských želv je Hexamita parva. Tento prvok žije primárně ve vylučovací soustavě (ledviny, močovody, močový měchýř) a vzhledem ke spojitosti vývodů cest vylučovacích a trávicích je lze najít i při koprologickém vyšetření čerstvého vzorku trusu. Hexamity bývají často spojovány s problémy ledvin (urátové usazeniny) nebo s kameny v močovém měchýři. Akutní případy se mohou navenek projevovat nepřirozeně zapáchající zelenou močí s příměsí krve. Průvodním jevem bývá i abnormálně rychlé změknutí krunýře, primárně nesouvisející s absencí dodávek vitamínu D3, UVB a minerálů. Někteří autoři (Highfield) jim připisují patologické změny ledvin vedoucí až k úhynům chovaných zvířat. Podle našich zkušeností byly hexamity přítomny ve vysokých množstvích u tohoročních importovaných mláďat Testudo graeca, které po dovozu velice rychle chřadly a hynuly. Při pitvě několika jedinců byly znatelné nepřirozeně zvětšené ledviny a obrovské tvrdé „kameny“ vyplňující v jednom případě téměř celý objem močového měchýře. Je však třeba říci, že podle našich zkušeností byly hexamity zjištěny i u několika dospělých jedinců Geochelone pardalis nebo Testudo horsfieldii, které po dobu sledování (několik let) neprojevovaly nejmenší příznaky onemocnění vylučovací soustavy. V každém případě je výhodné o přítomnosti těchto prvoků vědět a v případě potíží, které mohou souviset se správnou funkcí ledvin zajistit, aby díky hexamitám nedocházelo k dalšímu zhoršení zdravotního stavu zvířete. Nálevníci
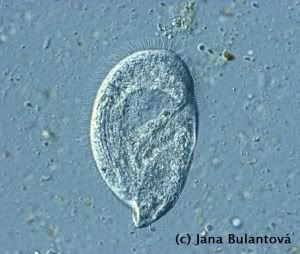
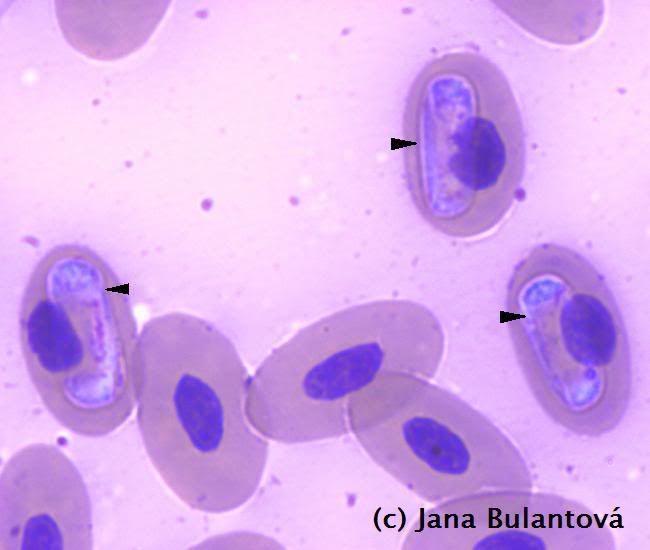
Z nálevníků se u želv vyskytují především různé druhy rodu Balantidium a Nyctotherus. Na jejich povrchu je vidět nespočet drobných brv, které slouží k pohybu (obr. 4). Žijí v zadní části trávicího traktu suchozemských želv (ale i mnoha jiných plazů, dokonce i jiných vzdálených skupin obratlovců a bezobratlých) a pro přenos využívají pevné cysty, zabraňující nežádoucímu poškození těla prvoka vně hostitele (obr. 5, 6). Jejich přítomnost v malých množstvích nevyvolává znatelné potíže, navýšení počtu cyst nebo i pohyblivých trofozoitů (aktivních stadií) v trusu ve spojitosti s průjmem může poukazovat na nevhodnou stravu, nerovnováhu střevní mikroflóry nebo na jiné střevní potíže (zánět). Mohou se stát problematickými ve chvíli, kdy je zvíře přeléčeno např. antibiotiky, která rovnováhu mezi střevními mikroorganismy významně ovlivňují.
Améby
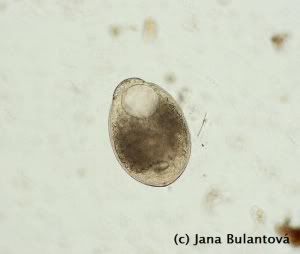
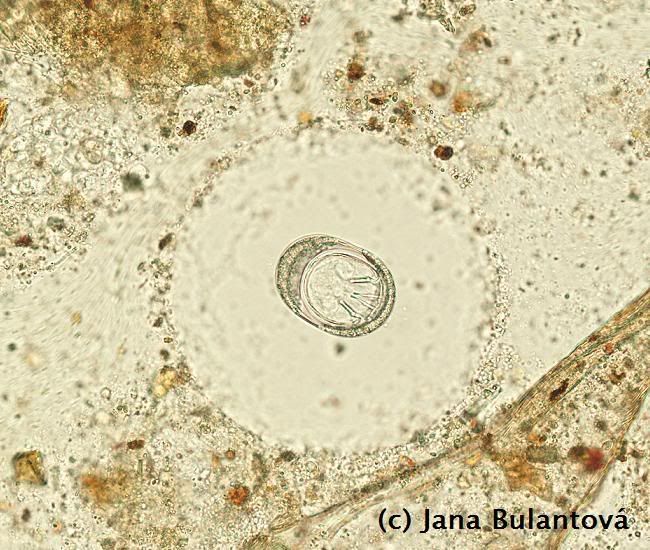
U želv se nejčastěji setkáme s měňavkami rodu Entamoeba. Tito prvoci mění tvar těla přeléváním tělního obsahu do panožek, pomocí kterých se pohybují. Trofozoiti žijí v zadní části tlustého střeva, ve vnějším prostředí tvoří améby odolné, obvykle čtyřjaderné cysty (obr.7).
U rodu Testudo je přítomnost améb obvykle bezpříznaková, klinické příznaky spojené s krvavým průjmem jsme zaznamenaly pouze u importovaných mláďat Geochelone pardalis a Geochelone (Asterochelys) radiata. I zde však mohl být špatný stav želv se závažným průběhem amébové infekce významně ovlivněn stresem z dlouhého převozu. Faktem však zůstává, že různé druhy plazů jsou k amébám různě citlivé. Zatímco většina želv s nimi problémy nemá, u hadů a ještěrů může infekce končit i smrtí zvířete za příznaků jako jsou krvavé průjmy, nechutenství a dehydratace. Při pitvě jsou na sliznici tlustého střeva patrné hluboké krvavé vředy způsobené nepřirozenou invazí améb z lumen střeva do jeho stěny.
Kokcidie
Kokcidie jsou u suchozemských želv poměrně vzácným úkazem. Do roku 2000 bylo pro čeleď Testudinidae známo méně než 10 druhů kokcidií (rody Eimeria a Isospora). Patologie není dobře prozkoumána. Pravděpodobně není vysoká, významnější riziko problémů se předpokládá u mláďat. Pro želvy rodu Geochelone a Indotestudo byly zjištěny patologicky významné intracelulární infekce jater a ledvin. Přesné zařazení těchto intracelulárních kokcidií a jejich vývoj je však prozatím neznámý. Hemogregariny (Haemogregarinidae)
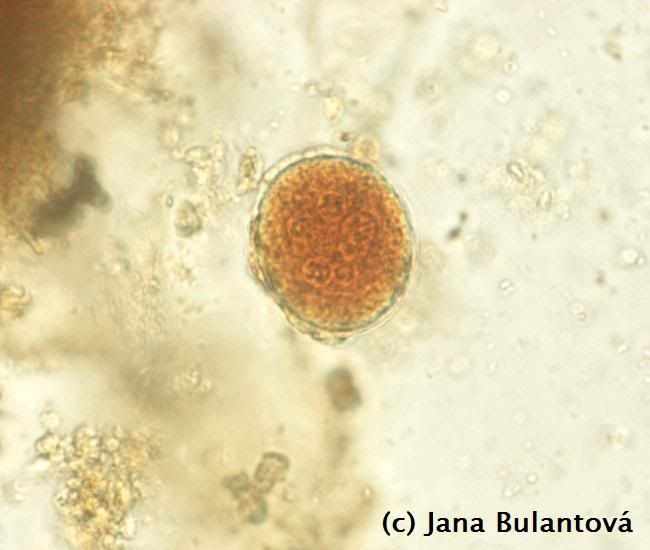
Tyto prvoky příbuzné kokcidiím nacházíme pouze u odchytových želv. V krvi je lze najít i u jedinců, chovaných v zajetí i po dobu několika let v zajetí bez možnosti nákazy (obr.8.).
O takovém pozitivním zvířeti lze s jistotou říci, že nepochází z tuzemského odchovu. Přenos nejčastěji nacházeného parazita rodu Hemolivia se totiž uskutečňuje pouze pozřením nakaženého klíštěte druhu Hyalomma aegyptium, které se u nás nevyskytuje. Parazitický prvok se vyvíjí především v orgánech, jako jsou játra a ledviny. Vývojová stádia se dostávají do krve a odtud do sajícího klíštěte. Nákaza se u želv nijak specificky neprojevuje, patologie je nízká a ne zcela probádaná. Předpokládá se mírný negativní vliv na parenchym jater a ledvin.
Parazitičtí červi (helminti)
Roupi
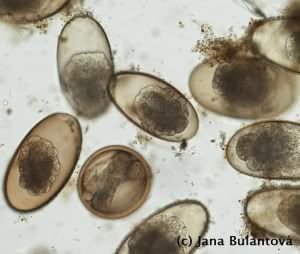
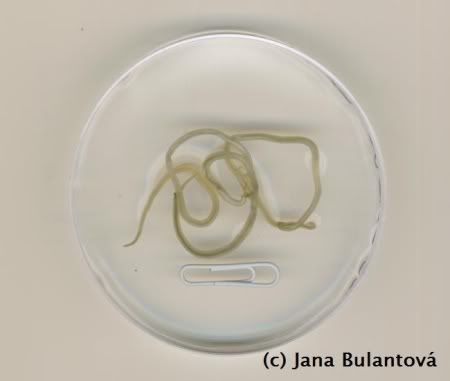
Naprostá většina volně žijících i v zajetí chovaných želv je infikována hlísticemi, konkrétně roupy (obr. 9, 10, 11).
Jsou to drobní červi kolem jednoho centimetru délky, vyskytující se v zadní části trávicího traktu želv. Protože nepotřebují mezihostitele, velice snadno dochází k přenosu na jiné želvy stejného druhu díky pozření infekčních vajíček (nebo živých larev), vylučovaných spolu s trusem. V zajetí rovněž dochází i k tzv. superinfekcím, kdy se již nakažená želva opětovně několikrát po sobě infikuje pozřením vlastního trusu, nebo kontaminovanou potravou. Ačkoli jsou specifičtí roupi v malém množství nepatogenní, na relativně malém prostoru terária nebo výběhu dochází k opakovaným infekcím, počet červů přítomných v trávicím traktu želvy může nepřiměřeně narůst a způsobit nepříjemnosti v podobě trávicích problémů, prolapsů kloaky, zácpy apod. Přestože se i nadále spekuluje o možnosti, že roupi jsou pro želvu vlastně symbiontem, který jí pomáhá správně trávit přijatou potravu, je vhodné brát v úvahu, že i tyto relativně neškodné organismy mohou být ve vyšších množstvích potenciálně nebezpečné. Vyplatí se proto dodržovat základní hygienu v želvím teráriu i ve výběhu, aby zbytečně nedocházelo ke kumulaci červů uvnitř těla želvy opakovanými nákazami. Důležité je zmínit, že i želví roupi jsou druhově velice specifičtí živočichové, specializovaní často k obývání jednoho druhu nebo skupiny příbuzných druhů hostitelů. Roupi, kteří jsou známí z evropských testud tak ve většině případů nenajdeme u želv rodu Geochelone a naopak.
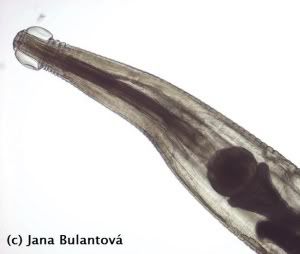
Škrkavky
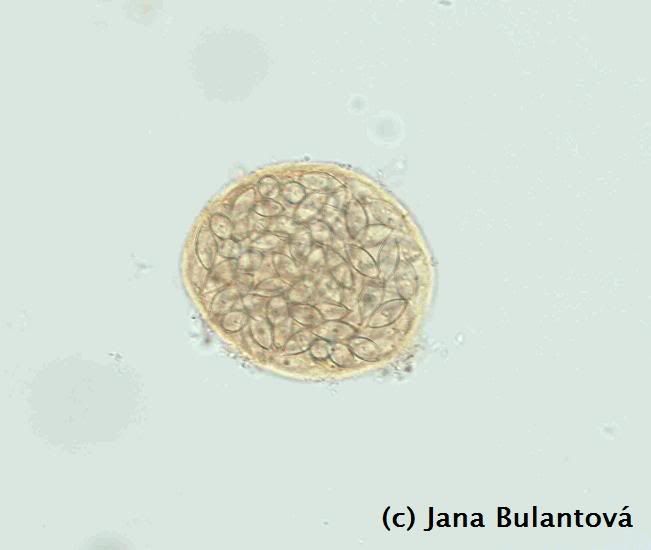
Nákaza škrkavkami může mít u želv velice závažný průběh (především u mláďat). Může za to především velikost těchto hlístic (mohou mít i 10 cm). Při přemnožení hrozí mimo jiné i perforace střeva želvy, vylití obsahu trávicího traktu do tělní dutiny a úhyn v důsledku sepse. Některé škrkavky jsou poměrně úzce specializované a méně nebezpené (např. drobnější rod Labiduris u želv rodů Geochelone a Kinixys), jiné jsou více problematické a mají i širokou škálu hostitelů (vzrostlá škrkavka Angusticaecum holopterum). K jejich vývoji není nezbytně potřeba mezihostitele, ačkoli některé druhy využívají různé druhy bezobratlých jako transportní organismy. Rozmnožují se vajíčky, některé skupiny (obr. 12) jsou živorodé. Se škrkavkami se můžeme stále setkávat i u odchovaných zvířat, a to především tam, kde mláďata přichází do styku s chovnými kusy, které nebyly na tyto parazity kontrolovány. Častější je jejich výskyt u tzv. faremních odchovů nebo odchytů, kde zvířata ve velkých koncentracích čekají, než budou poslána „zákazníkům“. Infekce se u zvířat v dobrém zdravotním stavu nemusí po dlouhou dobu vůbec projevit. Postupné hromadění červů v trávicím traktu želvy však má obvykle za následek špatné přírůstky, váhový úbytek a trávicí problémy. Mnoho chovatelů si infekce všimne teprve ve chvíli, kdy se v trusu ukáže uhynulý červ nezvyklých rozměrů (obr. 13).
Strongylidi
U suchozemských želv nejsou strongylidní hlístice nijak častým jevem (typičtější jsou pro akvatické druhy želv). Pokud se vyskytnou, je potřeba rychle zakročit. Tito červi jsou sice poměrně drobní (cca 1 cm), živí se však krví a narušováním sliznice působí negativně na správnou funkci tenkého střeva. Rychle se množí tenkostěnnými vajíčky s rychle se vyvíjející larvou. Ke svému vývoji nepotřebují mezihostitele a v krátké době mohou mít na svědomí poruchy vstřebávání živin a s tím spojený výrazný úbytek hmotnosti želv. Spiruridi
Nákaza spiruridy je typická spíše pro vodní nebo semiakvatické druhy želv, u suchozemských, převážně herbivorních druhů se vyskytují jen vzácně. Souvisí to s životním cyklem tohoto červa, který k přenosu nezbytně potřebuje mezihostitele, obvykle vodního bezobratlého. Parazitují nejčastěji v žaludku nebo tenkém střevě, dorůstají délky až několika centimetrů. Tasemnice a motolice
Přítomnost obou skupin parazitů je pro suchozemské želvy velice ojedinělá. Stejně jako v případě spiruridů je na vině životní cyklus červů, ve kterém naprostá většina tasemnic (obr. 14) a všechny motolice vyžadují přítomnost mezihostitele, spadajícího do potravního spektra definitivního hostitele. Proto je napadení plochými červy mnohem častější u těch skupin želv, které mají v přirozeném jídelníčku větší podíl živočišné potravy.
Léčba parazitóz Pouhé zjištění přítomnosti parazitů ještě nemusí nutně znamenat jejich léčbu. Vše je potřeba vidět v širších souvislostech spolu s klinickým stavem zvířete, popřípadě i s ohledem na probíhající léčbu zranění nebo jiného než parazitárního onemocnění. Přítomnost stabilního množství roupů, trichomonád nebo nálevníků obvykle není pro želvu nijak nebezpečná (promořenost roupy a trichomonádami se blíží 90 %). Při zjištění škrkavek a améb už bychom měli být obezřetnější. Škrkavky dokážou díky své velikosti napáchat nepěkné škody především u mláďat menších druhů želv, améby (pro želvy často neškodné) mohou být fatální pro hady nebo ještěry. U některých parazitů (hemogregariny) se léčba (která je navíc nespolehlivá) dokonce ani nedoporučuje. Preparát, kterým se parazitický prvok odléčuje, je poměrně toxický, a tak může želvě způsobit více problémů, než samotný parazit. Léčba jako taková by měla být chápána jako soubor opatření, která povedou k eliminaci parazita. A to nejenom z těla hostitele, ale i z okolního prostředí. Léčba škrkavek pouze u jediného zvířete ze skupiny je z dlouhodobého hlediska neúčinná, stejně jako odléčení zvířete bez toho, abychom zajistili likvidaci vajíček z prostředí terária nebo venkovního výběhu. Aplikaci léčiv je pak nezbytné dlouhodobě opakovat a slouží spíše k eliminaci parazitů před předpokládanou zátěžovou situací, jakou je třeba zimování. Podobným začarovaným kruhům neustálého preventivního odléčování můžeme snadno předejít karantenizací každého nově pořízeného zvířete a provedením parazitologického rozboru který nám ukáže, zda želva nemá některého nežádoucího parazita (především jde o škrkavky). Zabráníme tak zbytečnému rozsevu infekčních stadií patogenních organismů do definitivních terárií a výběhů. V každém případě je potřeba mít při léčbě zvířat na paměti, že každé antiparazitikum je vlastně jed, který více působí na parazita než na hostitele. Některé preparáty jsou speciálně pro želvy dokonce natolik toxické, že je mohou spolehlivě zabít. Proto varuji před neuváženým a neopodstatněným preventivním „zkrmováním“ jakýchkoli léčebných preparátů, protože každý do jisté míry organismus zvířete zatěžuje. Parazitologické omyly u suchozemských želv
„Moje želva dostává pampelišky z míst, kde pobíhají psi, kočky nebo divoká zvířata. Bojím se, že od nich chytne nějaké parazity.“
Paraziti jsou organismy velice specifické. Pokud se nedostanou do svého přirozeného hostitele tak hynou nebo se dále nevyvíjí. Stejné je to i s vnitřními parazity psů nebo koček. Organismus želvy jako studenokrevného živočicha je dostatečně odlišný na to, aby se v něm savčí parazit neuchytil. „Máme malé děti a bojíme se, aby od želv nechytily roupy.“ Želvy mají hned několik různých druhů roupů. Ani jeden nedokáže nakazit člověka nebo jakéhokoli jiného teplokrevného obratlovce. Člověk je hostitelem roupa dětského Enterobius vermicularis, který naopak nedokáže infikovat želvu, jiného plaza a dokonce ani jiného obratlovce s výjimkou některých primátů. „Moje želva prý umřela na trichomonády“ Trichomonády jsou prvoci přítomní takřka u každé klinicky zdravé želvy. Bičíkovci jsou často označováni jako potenciální patogeni, protože za normálních okolností nepůsobí potíže. Teprve za situace, kdy je tělo oslabeno třeba nějakou střevní infekcí může počet prvoků ve střevě neúměrně narůst a napomoci ke špatnému zdravotnímu stavu želvy. Po úhynu želvy jsou trichomonády ještě nějakou dobu ve střevě zjistitelné, a pokud není objeven jiný zjevný patogen (bakterie, virus), často jsou chybně považovány za primární příčinu úhynu. "Pod mikroskopem jsem viděl v trusu želvy nějaké parazity, a i když je už dlouho léčím různými preparáty, želva je má stále.“
Mohlo se stát mnoho věcí. Je dokonce možné, že se o parazity vůbec nejedná (rozpoznání některých je opravdu složité i pro zkušené oko). Lidé často považují za parazity trichomy nebo zbytky pletiv rostlin, gemule hub, spory plísní, pylová zrna, vajíčka půdních roztočů nebo i bublinky vzduchu. Další možnost je, že želva pozřela parazitovaného bezobratlého (žížalu). Vajíčka nebo cysty parazitů pak pasivně projdou trávicím traktem želvy (obr. 15) stejně jako třeba v případě, kdy želva spořádá exkrement nakaženého savce. Všichni tito „pseudoparaziti“ jsou pro želvu neškodní a jakákoli léčba je nejen neúčinná, ale i naprosto zbytečná a neúměrně zatěžuje želví organismus. Pokud tedy máte podezření, že Vaše želva má parazity, obraťte se pro jejich přesnou identifikaci nejlépe na nějaké specializované pracoviště, kde mají s plazími parazity zkušenosti. Tam by měli být schopni v případě potřeby doporučit i vhodnou léčbu. "V přírodě mají želvy taky spoustu parazitů, nikdo je neléčí a jak jsou spokojené." Terárium i výběh je oproti „přírodě“ velice omezený prostor s vysokou koncentrací zvířat. Želvy se častěji potkávají s vlastními výkaly, které někdy i požírají, a tím se zvyšuje koncentrace parazitů uvnitř těla hostitele. Pokud jsou v jednom teráriu kombinované skupiny želv různého původu (odchyt/odchov), parazitovaní jedinci mohou nakazit svoje „spolubydlící“. Komplikovanější jsou případy, kdy se třeba evropská želva setká se želvou z jiného kontinentu a jedna z nich je bezpříznakovým hostitelem organismu, který je pro jinou želvu vysoce patogenní.
„Želvy v přírodě jsou prolezlé parazity hlavně díky tomu, že požírají trus jiných zvířat.“ Želvy se mohou nakazit parazity zase jen od jiných želv, případně pozřením mezihostitelského organismu, který je schopen želví parazity přenášet. Pozření např. koňského trusu s vývojovými stadii koňské škrkavky znamená pouze to, že vajíčka parazita beze změny projdou trávicím traktem, aniž by se želva nakazila. (c) Jana Bulantová (bulantov@natur.cuni.cz] Odd. parazitologie PřF UK Viničná 7 Praha 2 128 44 Doporučené materiály k rozšíření přehledu o parazitech suchozemských želv BARNARD, S. M. & UPTON, S. J. (1994): A Veterinary Guide to the Parasites of Reptiles – Volume 1: Protozoa. Malabar, Florida (Krieger Publishing Company): 154 pp. BECK, W. & PANTCHEV, N. (2006): Practische Parasitologie bei Heimtieren. Hannover (Schlütersche Verlagsgesellschaft mbH & Co. KG): 229 – 293. CORTON, M.: Understanding common worms and protozoa. http://www.tortoisetrust.org/articles/parasites.html DUSZYNSKI, D., W., UPTON, S., J. & COUCH, L. (2008): Coccidia (Eimeria and Isospora) of Chelonia. http://biology.unm.edu/biology/coccidia/chelonia.html FRANK, W. (1985): Amphibien und Reptilien. In: ISENBÜGEL, E. & W. FRANK (eds): Heimtierkrankheiten. Stuttgart (Ulmer): 161-402. FRYE, F. L. (1991): Reptile care – an atlas of diseases and treatments. Volume 1. & 2.; Neptune City (T. H. F.); 637 pp. GARNER, M. M., GARDINER, C., H., WELLEHAN, J., F., X., JOHNSON, A., J., McNAMARA, T., LINN, M., TERRELL, S., P., CHILDRESS, A. & JACOBSON, E., R. (2006): Intranuclear coccidiosis in tortoises: Nine cases. Veterinary pathology 43, 311-320. HIGHFIELD, A., C.: Protozoan infections in chelonians. http://www.tortoisetrust.org/articles/proto.html HŮRKOVÁ, L., MODRÝ, D., KOUDELA, B. & ŠLAPETA, J. (2000): Description of Eimeria motelo sp. n. (Apicomplexa: Eimeriidae) from the Yellow Footed Tortoise, Geochelone denticulata (Chelonia: Testudinidae), and Replacement of Eimeria carinii Lainson, Costa & Shaw, 1990 by Eimeria lainsoni nom. nov. Memórias do Instituto Oswaldo Cruz. 95, 829-832. KÖHLER, G. (2002): Nemoci obojživelníků a plazů. Praha (Brázda): 166 pp. SCHNELLER, P. & PANTCHEV, N. (2008): Parasitologie bei Schlangen, Echsen und Schildkröten: Ein Handbuch für die Reptilienhaltung. Frankfurt am Main (Edition Chimaira): 205 pp. TRAVERSA, D., CAPELLI, G., IORIO, R., BOUAMER, S., CAMELI, A. & GIANGASPERO, A. (2005): Epidemiology and biology of nematodofauna affecting Testudo hermanni, Testudo graeca and Testudo marginata in Italy. Parasitology Research 98, 14-20.
Copyright ©2008 www.zelvy.wbs.cz
|